Historia de la maquina de vapor
Hoy en día es común pensar que en el complejo proceso de creación, asimilación y
aplicación del conocimiento científico, la tecnología es la última etapa que emana de
la investigación científica. Si bien es cierto que existe una complicada interrelación
entre la ciencia y la tecnología, al grado que es difícil pensar que ésta última sea
ajena al quehacer científico, no siempre fue así. Cierto es que por ejemplo las
comunicaciones, alámbricas e inalámbricas, surgen de la comprensión del
comportamiento del campo electromagnético a través de los estudios de Faraday,
Maxwell y Hertz en la segunda mitad del siglo pasado. Así, una tecnología emanó de
los resultados de la investigación científica. Pero en el caso de los dispositivos que
transforman energía y en particular energía térmica en trabajo mecánico, la
situación fue completamente la opuesta.
Estos últimos dispositivos, que ahora
llamaremos máquinas térmicas se desarrollaron desde su forma más incipiente, en
el siglo XVIII, hasta prácticamente la forma en que las conocemos hoy en día, lo
que ocurrió ya hacia mediados del siglo XIX, sin que hubiese existido la menor
comprensión sobre las causas teóricas, esto es, la explicación científica de su
funcionamiento. Hagamos pues un poco de historia.
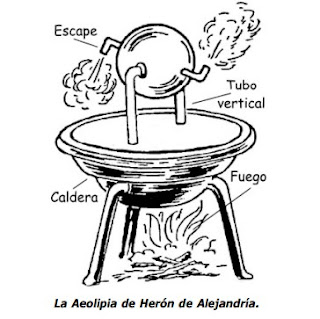
La primera máquina térmica de que tenemos evidencia escrita fue descubierta por
Hero de Alejandría (~ 130 a.C.) y llamada la aeolipila. Es una turbina de vapor
primitiva que consiste de un globo hueco soportado por un pivote de manera que
pueda girar alrededor de un par de muñones, uno de ellos hueco.
Por dicho muñón
se puede inyectar vapor de agua, el cual escapa del globo hacia el exterior por dos
tubos doblados y orientados tangencialmente en direcciones opuestas y colocados
en los extremos del diámetro perpendicular al eje del globo. Al ser expelido el
vapor, el globo reacciona a esta fuerza y gira alrededor de su eje.
En la misma obra de Hero se describe también el primer prototipo de una máquina
de presión, que después fue motivo de varios estudios por Matthesuis en Alemania
en 1571, de Caus en Francia en 1615 y en Italia por Ramelli en 1588, della Porta en
1601 y Branca en 1629.
Posteriormente, en 1663, Edward Somerset, el segundo marqués de Worcester, en
su obra Un siglo de invenciones describe un método para elevar un volumen de
agua usando vapor. Su descripción es obscura y carece de dibujos; y subsiste la
duda de si construyó o no la máquina. No fue sino hasta los años de 1698 a 1725
cuando la idea de Somerset fue puesta en práctica y utilizada para satisfacer
diversas necesidades.
En 1698 Thomas Savery obtuvo una patente para una
máquina utilizada para elevar cantidades considerables de agua. Su funcionamiento
consistía esencialmente en inyectar vapor a un recipiente lleno de agua hasta vaciar
su contenido por un tubo vertical a través de una válvula de seguridad. Cuando el
recipiente se vacía cesa el suministro de vapor y el vapor contenido se condensa por
medio de un chorro de agua fría que cae sobre las paredes exteriores de dicho
recipiente y que proviene de una cisterna colocada en su parte superior. Esto
produce un vacío y permite que otro tubo, controlado por otra válvula de seguridad,
aspire agua del pozo distribuidor a cualquiera que sea la fuente. Entre tanto, una
operación paralela se lleva a cabo en otro recipiente semejante al primero.
El vapor
se suministra de un horno que consiste de una caldera principal que tiene una alimentación continua de agua caliente la cual proviene de otro horno que calienta
agua fría por el fuego encendido en su hoguera. Los niveles de agua en las calderas
se controlan por sendas válvulas de presión.
Esta máquina, que puede considerarse como la primera máquina de vapor, encontró
un uso considerable en la extracción de agua de las minas de carbón y en la
distribución de agua para casas habitación y pequeñas comunidades.
Esta máquina
fue subsecuentemente modificada de diversas maneras, todas ellas destinadas a
mejorar la cantidad de agua y la altura a que ésta podía elevarse, ya que estas
características estaban limitadas por la presión que podían soportar las calderas. Ya
en 1690 Denis Papin había sugerido que la condensación de vapor se debería usar
para producir un vacío debajo de un pistón que previamente se había elevado por la
acción del vapor.
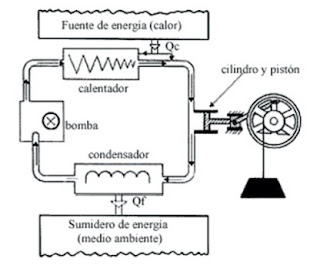 |
Figura esquemática de una máquina o planta de vapor. El agua es
bombeada a un calentador donde hierve y se evapora al aumentar la presión del
cilindro para empujar al pistón hasta enfriarse a la temperatura y presión del
condensador en el cual condensa y vuelve a ser bombeada para completar el ciclo.
Ésta fue la primera versión de una máquina de vapor usando un cilindro y un pistón. En 1705 Thomas Newcomen y John Cawley, su asistente, mejoraron la operación del pistón al forzar su caída por acción de la presión atmosférica. Al hacerlo producía trabajo mecánico sobre una bomba que introducía el agua por bombear. Después de varios ajustes técnicos estas máquinas fueron producidas en gran tamaño y en serie por John Smeaton hasta que en 1770 fueron superadas por las innovaciones debidas a James Watt. (Figs. 1)

En 1763 este notable fabricante de instrumentos escocés, al reparar una de las máquinas de Newcomen se sorprendió de ver el enorme desperdicio de vapor que ocurría durante el proceso de calentamiento y enfriamiento del cilindro, dentro del cual operaba el pistón. El remedio, en sus propias palabras, consistiría en mantener al cilindro tan caliente como el vapor de entrada. Después de seis años sus experimentos lo llevaron a patentar, en 1769, una máquina que superaba a las de su antecesor por su mayor rapidez en la carrera del pistón y por ser mucho más económica en cuanto al consumo de combustible, sin embargo estaba reducida al bombeo y adolecía de otras limitaciones técnicas.
La forma en que estas limitaciones fueron superadas queda fuera de contexto, pero
vale la pena subrayar que el propio Watt en 1781 ideó la forma de usar la máquina
para hacer girar un eje y por lo tanto, abrir sus aplicaciones a muchos otros usos
además del bombeo.
En manos de inventores notables como Trevitchik y Woolf en Inglaterra, Evans en
los EUA , Cugnot en Francia y otros, esta máquina llegó a un estado de perfección
tal que en 1829 George Stephenson fue el primero en adaptarla a una locomotora
esencialmente en la misma forma usada por las más pesadas locomotoras actuales.
También, en 1802 fue usada por vez primera por W. Symington para navegar el
remolque Charlotte Dundas. Posteriormente, en 1807, el norteamericano Robert
Fulton hizo navegar un barco en el río Hudson con máquinas de vapor diseñadas por
Boulton y Watt.
Entre esos años y las postrimerías del siglo pasado, con mejoras en el diseño y la
construcción, la máquina de vapor se transformó en la máquina habitual para la
navegación marina lográndose alcanzar presiones de vapor muy altas y velocidades
de pistón considerables. Con la invención de la turbina de vapor la navegación
marina adquirió su máximo grado de desarrollo, sólo superado posteriormente por
el advenimiento de los combustibles nucleares. En la turbina de vapor, desarrollada
por Parsons en 1884 y perfeccionada por Laval en 1889, la presión del vapor se
utiliza para poner directamente al fluido en movimiento y no al pistón.
En todo este proceso de invenciones e innovaciones los inventores difícilmente
tuvieron una teoría, como la electromagnética en el caso de la radio, que les guiara
en su camino. Los termómetros producto de la obra de Gabriel Fahrenheit en 1717,
eran reproducibles con un alto grado de precisión y surgieron de la necesidad de
subsistir con un instrumento más preciso las sensaciones de frío y caliente que al
tacto son difíciles de cuantificar.
De hecho, mucho antes de su construcción,
científicos como Leonardo da Vinci, Galileo y otros sabían que al contacto con un
tercer cuerpo, usualmente el aire, dos o más cuerpos en contacto con él "se
mezclaban de una manera apropiada" hasta alcanzar una misma "condición". De ahí
la palabra temperatura que proviene del latín temperare que significa "mezclar
apropiadamente" o templar. Pero para nadie era claro qué mecanismo estaba
implícito en ese mezclado.
En 1620, sir Francis Bacon en su célebre obra Novum Organum propuso un método
para estudiar e interpretar la naturaleza y eligió la naturaleza del calor para
ilustrarlo. El método consiste de tres pasos: el primero, listar todas las "instancias
asociadas a la ‘naturaleza’" que se desea investigar; el segundo es una revisión
crítica de la lista y el tercero un proceso de inducción para formular la interpretación
fundamental del fenómeno. Aplicada al calor es ilustrativo, pues pone de relieve las
ideas que al respecto prevalecían en ese entonces: la forma o verdadera definición
de calor es como sigue: calor es un movimiento, expansivo, restringido y actuando
en su contienda sobre las partículas más pequeñas de los cuerpos.
Aunque se realizaron muchos esfuerzos para explicar los procesos que se pensaban
ocurrían al experimentar con la ayuda de termómetros, fue Joseph Black un médico
y químico escocés, quien a mediados del siglo XVIII aclaró la distinción entre calor y
temperatura.
En sus Lecciones sobre los elementos de la química, publicada
póstumamente en 1803 y editada por su alumno y colega John Robison, Black
distingue con toda precisión la diferencia entre calor y temperatura e introduce por
primera vez los conceptos de calor específico y calor latente. De esta obra vale la
pena citar al pie de la letra:
- Un avance en nuestro conocimiento sobre el calor, que puede lograrse
mediante el uso de termómetros, es la noción mucho más clara que hoy
tenemos sobre la distribución del calor en cuerpos diferentes. Aun sin la ayuda de termómetros podemos percibir la tendencia del calor a difundirse de
cualquier cuerpo caliente hacia otros más fríos en sus alrededores, hasta que
el calor se distribuye entre ellos de una manera tal que ninguno es capaz de
tomar más que los restantes. Así pues, el calor alcanza un estado de
equilibrio.
La naturaleza de este equilibrio no se comprendía bien hasta que discerní un
método para investigarlo. Se han adoptado muchos puntos de vista al
respecto, todos un tanto apresurados, como es imaginarse que en dicho
equilibrio hay una misma cantidad de calor en cada volumen igual del
espacio, independientemente de cómo se llene éste con cuerpos diferentes.
Esto es confundir la cantidad de calor en diferentes cuerpos con su intensidad
(temperaturas), aunque es claro que ambas cosas son diferentes.
En términos contemporáneos no sólo apunta Black al hecho de que calor y
temperatura son dos conceptos estrictamente diferentes, sino que además apunta
al bien conocido hecho de que los calores específicos de substancias diferentes, son
diferentes. De sus experimentos al mezclar agua y mercurio a diferentes
temperaturas iniciales cita:
- Se pone de manifiesto que la cantidad de calor requerida para hacer 2
volúmenes de agua más caliente, digamos por 25 grados, es suficiente para
hacer a 3 volúmenes de mercurio más calientes por el mismo número de
grados. Esto es, el mercurio tiene una menor capacidad para el calor1
(si se
me permite usar la expresión) que el agua...
Sobre los calores latentes sus observaciones fueron no menos agudas. Citamos: "La
opinión que me he formado de una observación minuciosa de los hechos y
fenómenos es como sigue: Cuando el hielo u otra sustancia sólida se funde, soy de
la opinión que recibe una cantidad de calor mayor que la perceptible a través del
termómetro inmediatamente después de la fusión... Este calor debe agregarse para
darle la forma de un líquido; cuando congelamos un líquido, este emite una gran cantidad de calor... En los procesos ordinarios de la congelación del agua, la
extracción y surgimiento de calor latente, si se me permite usar el término, se lleva
a cabo por etapas diminutas... que muchos pueden encontrarse difíciles de
comprender..."
Pero hasta el momento nada se ha dicho sobre la naturaleza misma del calor. En
1783 el famoso químico Henry Cavendish al referirse al frío generado por la fusión
del hielo y el calor producido por la congelación de agua observó:
- Se me ha dicho que el Dr. Black explica estos fenómenos de la misma
manera, sólo que en lugar de usar la expresión, calor se genera o produce, él
habla de la liberación o emisión del calor latente. Sin embargo como esta
expresión es una hipótesis que depende de la suposición de que el calor de
los cuerpos es debido a su mayor o menor contenido de una substancia
llamada la materia del calor, y compartiendo yo la opinión de sir Isaac
Newton de que el calor consiste del movimiento interno de las partículas que
forman los cuerpos, con mucho lo más probable, yo elijo usar la expresión, el
calor es generado...
El texto de Cavendish no sólo arroja luz sobre las controversias existentes en
aquella época acerca de la naturaleza del calor, sino que además exhibe claramente
la idea que el gran Newton tenía sobre el calor, muy cercana a la interpretación
moderna basada en la teoría molecular de la materia. ¿Y Black mismo? Aunque
mucho se dice que él nunca sostuvo con convicción una teoría específica sobre el
calor, sus escritos muestran que estaba consciente de la polémica acerca de la
naturaleza del calor. Dicha polémica originada desde el tiempo de los griegos y
suscrita por Robert Boyle en su obra Ensayos sobre efluvios sugería que el calor era
una substancia material que se comportaba como un fluido elástico, sutil, que
llenaba todos los cuerpos y cuya densidad aumentaba con la temperatura.
Este fluido se concebía como formado partículas que se repelen entre sí pero son
atraídas a las partículas de materia ordinaria.
Cada partícula de materia está
entonces rodeada de una atmósfera de calórico de manera que dos partículas
materiales se repelen entre sí a cortas distancias, aunque a distancias grandes la
atmósfera se atenúa y predomina la fuerza atractiva de la gravedad; así existe un punto de equilibrio intermedio en el cual la fuerza neta es cero. Si la temperatura
aumenta y se agrega fluido a la sustancia, el punto de equilibrio se desplaza hacia
el exterior aumentando la distancia promedio entre las partículas y produciendo así
una expansión del cuerpo. Bajo una compresión el fluido se comprime y aparece en
la superficie como calor emitido. Esta teoría aunque opuesta al concepto de
movimiento propuesto por Bacon y sostenido por Newton y otros filósofos ingleses,
llegó a tener una aceptación general al grado que en 1787 el célebre químico
Lavoisier y otros científicos franceses, al hacer una revisión de la terminología
química, llamaron a este fluido el "calórico".
Antes de volver a nuestra pregunta inicial acerca de la teoría inexistente sobre el
funcionamiento de las máquinas térmicas conviene mencionar algunas anécdotas
adicionales.
De acuerdo con la teoría de Black cuando un cuerpo se licúa o se congela (solidifica)
el calor latente emitido o absorbido resultaba de la combinación de una cantidad
definida del calórico con cada partícula material de la sustancia en cuestión. Al
concebir al calor como el calórico surgió de manera natural la pregunta acerca de
cómo medir su peso. Esta cuestión fue abordada por Benjamin Thomson, más tarde
el conde Rumford, en 1798 y en 1799 por el notable químico H. Davy.
Después de
una serie de experimentos que más tarde se reconocieron como una evidencia clara
para desechar la existencia del calórico, concluyeron que el peso de dicho fluido
nunca podría determinarse.
En su época, estos experimentos no se estimaron como objeciones serias a la teoría
del calórico porque sus ejecutantes, Davy y Rumford, no propusieron una teoría
alternativa coherente; no explicaron cómo si el calor es movimiento de partículas
(moléculas) puede transferirse de una substancia a otra. Por otra parte, el calor
radiante se usaba en todas sus manifestaciones como un fuerte apoyo a la teoría
del calórico: como el calor podía atravesar el vacío sin provocar ningún movimiento
de materia, debía ser una substancia y no una propiedad de la materia.
No obstante estas controversias, no existía evidencia conclusiva y contundente para
descartar la teoría del calórico, hasta que a fines del siglo XVIII el conde Rumford,
que fungía entonces como superintendente del arsenal de Münich, percibió una
cantidad de calor muy considerable que se producía al horadar un cañón y el calor aún más intenso de las astillas metálicas que se producían en dicha operación.
Citando su propio texto publicado en 1798:
- Cuanto más meditaba sobre estos fenómenos más me parecían curiosos e
interesantes. Una investigación más exhaustiva sobre ellos parecería justo
que arrojara un mayor entendimiento acerca de la naturaleza oculta del calor
y permitirnos así formar juicios más certeros con respecto a la existencia o
inexistencia de "un fluido ígneo"; un tema sobre el cual las opiniones de los
filósofos de todas las épocas han estado muy divididas. ¿De dónde proviene
todo el calor producido en las operaciones mecánicas arriba mencionadas?
Inspirado en estas ideas, Rumford decidió llevar a cabo varios experimentos para
responder a estas cuestiones. Construyó un cilindro de bronce que pudiera ajustarse
a un taladro de acero filoso. Este taladro se forzaba en contra de la parte inferior del
cilindro y al cilindro se le hacía girar sobre su eje por medio de una máquina
taladradora operada con caballos. En su experimento más espectacular todo el
cilindro y el taladro se ponían dentro de una caja hermética llena con agua
inicialmente a una temperatura normal (18º C) y la máquina se ponía en
movimiento. El cilindro se hacía girar a 32 vueltas por minuto. Al poco tiempo de
operar. Rumford percibió un calentamiento del cilindro y del agua. Citando. "Al cabo
de una hora encontré, introduciendo un termómetro en el agua, que su temperatura
había aumentado no menos de 9º C y al cabo de dos horas con 20 minutos era de
94º C, y a las dos horas y media ¡el agua hervía! Sería difícil describir la sorpresa y
aturdimiento reflejado en el semblante de los espectadores al ver una cantidad de
agua fría, calentarse y hervir, sin nunca haber encendido un fuego."
De estos experimentos, Rumford concluyó que la fuente generada por la fricción es
inagotable y señaló que cualquier cosa que uno o varios cuerpos puedan generar sin
límite alguno no puede ser substancia material.
Por consiguiente, de los experimentos realizados es difícil, si no imposible,
identificar al calor generado con otra cosa que no sea el movimiento. Aunque el
efecto de estos experimentos fue debilitar seriamente las bases en que se
sustentaba la teoría del calórico, tuvieron que pasar otros cincuenta años antes de
que estos puntos de vista fueran totalmente aceptados.
La discusión anterior exhibe con cierto detalle el escenario en que evolucionó la
tecnología de las máquinas térmicas, en la medida, como dijimos antes, de tener a
la mano una teoría que guiara su desarrollo. En efecto, tal teoría, hasta 1840 no
existió y la evolución de la tecnología fue casi empírica.
La primera persona que planteó la interrogante esencial del problema, a saber,
conocer el principio o los principios que rigen el funcionamiento de estas máquinas,
fue el brillante ingeniero francés N. Sadi Carnot (1796-1832). En 1824 publicó su
famosa memoria Reflexiones sobre la potencia motriz del calor y sobre las máquinas
apropiadas para desarrollar esta potencia, en donde se dedicó a razonar sobre la
pregunta general de cómo producir trabajo mecánico (potencia motriz) a partir de
fuentes que producen calor. Citamos de su obra:
|
- Todo el mundo sabe que el calor puede causar movimiento, que posee una
gran fuerza motriz: las máquinas de vapor tan comunes en estos días son
una prueba vívida y familiar de ello... El estudio de estas máquinas es de
gran interés, su importancia es enorme y su uso aumenta cada día. Parecen
destinadas a producir una gran revolución en el mundo civilizado...
A pesar de estudios de todos los tipos dedicados a las máquinas de vapor y a
pesar del estado tan satisfactorio que han alcanzado hoy en día, su teoría ha
avanzado muy poco e intentos para mejorarlos están basados casi en el azar.
A menudo se ha planteado la cuestión sobre si la potencia motriz del calor es
limitada o infinita; el que si mejoras posibles a estas máquinas de vapor
tienen un límite asignable, un límite que, en la naturaleza de las cosas, no
pueda excederse por medio alguno, o si, por lo contrario, estas mejoras
pueden extenderse indefinidamente.
Para visualizar en su forma más general el principio de la producción de
trabajo a partir del calor debemos pensar en ello independientemente de
cualquier agente; debemos establecer argumentos aplicables no sólo a las
máquinas de vapor sino a cualquiera que sea su forma de operar.
Es realmente a partir de estas ideas de las cuales surgió toda la teoría moderna de
las máquinas térmicas y, como veremos más adelante, se llegó a la formulación del
no siempre muy claro segundo principio de la termostática. Pero volvamos con Carnot para comprende mejor sus ideas concebidas todavía durante la época en que
la teoría del calórico era, inclusive para él mismo, muy aceptada. El punto clave
consiste en reconocer que una máquina térmica (o de vapor) requiere de una
diferencia de temperaturas para poder operar. Citamos:
- La producción de movimiento en una máquina de vapor va siempre
acompañada por una circunstancia a la que debemos poner atención. Esta
circunstancia es el re-establecimiento del equilibrio en el calórico, esto es, su
flujo desde un cuerpo cuya temperatura es más o menos elevada a otro cuya
temperatura es menor.
En otras palabras, cuando la máquina opera entre dos cuerpos y extrae de calor del
más caliente, cede una cantidad de calor al cuerpo más frío hasta igualar las
temperaturas de ambos, esto es, hasta restaurar el equilibrio térmico.
 |
Figura 2. Una máquina térmica extrae /Q2/ unidades de calor de una fuente a
temperatura T2 y desecha una cantidad menor - /Q1/ a la fuente fría. Ésta,
usualmente el medio ambiente, se encuentra a una temperatura T1 menor que T2.
Por la conservación de la energía, el trabajo neto realizado por la máquina, si ésta
es ideal (no hay fricción) es - W = /Q2/ - /Q1/
Más aún, señala que cuando la restauración del equilibrio ocurre sin producir
trabajo, éste debe considerarse como una pérdida real (Fig. 2). En el lenguaje más
moderno diríamos que a diferencias de temperatura entre dos o más cuerpos
tienden a desaparecer espontáneamente al fluir el calor de los más calientes a los
más fríos sin producir trabajo útil.
De aquí entonces se le ocurre a Carnot pensar que una máquina térmica eficiente
debe diseñarse de manera que no existan flujos de calor desaprovechables durante
su operación. Para ello se le ocurre idear un proceso cíclico en el cual sólo aparecen
la fuente térmica de la cual la máquina extrae calor para operar y la fuente fría a la
cual se le suministra el calor no aprovechable. Citamos:
|
- Imaginemos un gas, aire atmosférico por ejemplo, encerrado en un recipiente
cilíndrico abcd (ver figura 3) que tiene un pistón movible cd; además sean A y
B dos cuerpos cada uno mantenido a una temperatura constante, la de A
mayor que la de B; e imaginemos las siguientes operaciones:
- Ponemos en contacto al cuerpo A con el aire encerrado en el espacio abcd a
través de una de sus caras, ab digamos, que suponemos conduce calor
fácilmente. A través de este contacto el aire alcanza la misma temperatura
que la del cuerpo A; cd es la posición presente del pistón.
- El pistón se eleva gradualmente hasta tomar la posición ef. Se mantiene el
contacto con el cuerpo A y el aire, el cual por lo tanto se mantiene a una
temperatura constante durante la expansión. El cuerpo A suministrará calor
necesario para mantener dicha temperatura constante.
- El cuerpo A se retira de manera que el aire no esté ya en contacto con
cualquier cuerpo que pueda suministrar calor: el pistón, sin embargo,
continúa moviéndose y pasa de la posición ef hasta la posición gh. El gas se
expande sin recibir calor y su temperatura disminuye. Imaginemos que
disminuye en esta forma hasta que alcanza un valor igual a la temperatura
del cuerpo B. En este punto el pistón se para y ocupa la posición gh.
- El aire se pone en contacto con el cuerpo B; se comprime por el regreso del
pistón a medida que se mueve de la posición gh a la posición cd. No
obstante, el aire se mantiene a una temperatura constante por su contacto
con el cuerpo B al cual le cede su calor.
- Se retira el cuerpo B y continuamos la compresión del aire el cual, ahora
aislado, aumenta su temperatura. La compresión se continúa hasta que el
aire alcance la temperatura del cuerpo A. Durante este proceso el pistón pasa
de la posición cd a la posición ik.
- El aire se pone de nuevo en contacto con el cuerpo A; el pistón regresa de la
posición ik a la posición ef; la temperatura permanece constante.
- La operación descrita en 3, se repite y sucesivamente 4, 5, 6, 3, 4, 5, 6, 3, 4,
5,... y así sucesivamente.
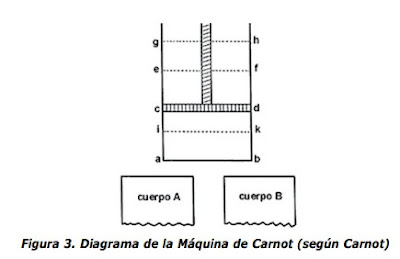
Sobre este proceso cíclico Carnot hace ver que la substancia operante (el aire)
realiza una cantidad de trabajo neta y además que este trabajo se produce de la
manera más ventajosa posible. Los dos procesos 3 y 5 en que el aire está aislado
cambian su temperatura sin remover o ceder calor. En esta forma el aire siempre se
pone a la temperatura deseada, la del cuerpo A y B respectivamente, antes de
ponerlo en contacto con ellos; se elimina pues cualquier flujo de calor espurio entre
cuerpos a diferentes temperaturas. También, hace notar que la secuencia de
operaciones arriba descrita puede llevarse a cabo en el sentido opuesto, lo cual
implica que al terminar el paso 6) se llevan a cabo las operaciones en el orden 5, 4, 3, 6, 5, 4, etc. En este caso el resultado es el de consumir una cierta cantidad de
trabajo igual a la producida en el ciclo inicial y regresar todo el calor del cuerpo B al
cuerpo A. Finalmente, Carnot demuestra que no puede concebirse una máquina
térmica más eficiente operando entre dos temperaturas prescritas que la suya y
anuncia una de sus proposiciones fundamentales:
- La fuerza motriz del calor es independiente de los agentes usados en
producirla; su cantidad está determinada unívocamente por las temperaturas
de los dos cuerpos entre los cuales ocurre, finalmente, el transporte del
calórico.
Así se veían los procesos subyacentes a las máquinas térmicas, incluyendo las de
vapor durante la tercera década del siglo XIX. El porqué no tuvo mayor impacto el
trabajo de Carnot, que contiene el reconocimiento claro entre la equivalencia entre
calor y trabajo así como la imposibilidad de construir una máquina de movimiento
perpetuo, principio ahora conocido como la segunda ley de la termodinámica, fue
debido a que sus colegas franceses lo ignoraron por completo. Sólo Emile
Clapeyron, un colega de Carnot de la École Polytéchnique, publicó un escrito en
1834 mencionando su trabajo. Fue sólo en Alemania y en Inglaterra que sus ideas
fueron apreciadas e incorporadas en la teoría moderna del calor, y fueron la fuente
esencial de donde emanaron las leyes de la termostática.






muy completo
ResponderEliminar