METALES EN LA INGENIERÍA
ALEACIONES Y DIAGRAMAS DE FASE
Aunque ciertos metales son importantes como metales puros (por ejemplo, oro, plata, cobre), la mayor parte de las aplicaciones de ingeniería requiere de las propiedades mejoradas que se obtienen con la aleación. Con ésta es posible mejorar la resistencia, dureza y otras pro piedades, en comparación con las de los metales puros. En esta sección, se definen y clasifican las aleaciones; después se estudian los diagramas de fase, que indican las fases de un sistema de aleación como función de la composición y la temperatura.Aleaciones
Una aleación es un metal compuesto de dos o más elementos, al menos uno de los cuales es metálico. Las dos categorías principales de aleaciones son 1) soluciones sólidas, y 2) fases intermedias.
Soluciones sólidas Una solución sólida es una aleación en la que un elemento se disuelve en otro para formar una estructura de fase única. El término fase describe una masa homogénea de material, como la de un metal en el que todos los granos tienen la misma estructura reticular cristalina. En una solución sólida, el solvente o elemento base es metálico, y el elemento disuelto puede ser metálico o no metálico. Las soluciones sólidas vienen en dos formas, que se ilustran en la figura 6.1. La primera es una solución sólida sustitucional, en la que los átomos del elemento solvente son remplazados en su celda unitaria por el elemento disuelto. El latón es un ejemplo de esto, en el que el zinc está disuelto en cobre. Para hacer la sustitución deben satisfacerse muchas reglas ([2], [5], [6]): 1) el radio atómico de los dos elementos debe ser similar, por lo general dentro de un 15%; 2) sus tipos de retículas deben ser las mismas; 3) si los elementos tienen valencias diferentes, es más probable que el metal de valencia menor sea el solvente; y 4) si los elementos tienen afinidad química elevada uno por el otro, es menos probable que formen una solución sólida y más que constituyan un compuesto.
En ambas formas de la solución sólida, por lo general la estructura aleada es más fuerte y dura que cualesquiera de los elementos que la componen.
Fases intermedias Por lo general hay límites a la solubilidad de un elemento en otro. Cuando la cantidad del elemento solvente en la aleación excede el límite de solubilidad sólida del metal base, en la aleación se forma una segunda fase. Para describirla se emplea el término fase intermedia debido a que su composición química es intermedia entre los dos elementos puros. Su estructura cristalina también es diferente de aquella de los metales puros. En función de la composición, y con el reconocimiento de que muchas aleaciones consisten en más de dos elementos, dichas fases intermedias pueden ser de varios tipos, incluyendo 1) compuestos metálicos que consisten en un metal y un no metal, como el Fe3 C; y 2) compuestos intermetálicos, dos metales que forman un compuesto, como el Mg2 Pb. Es frecuente que la composición de la aleación sea tal que la fase intermedia se mezcle con la solución sólida primaria para formar una estructura de dos fases, una dispersa en la segunda. Estas aleaciones de dos fases son importantes porque pueden formularse y ser tratadas térmicamente para darles una resistencia significativamente más elevada que la de las soluciones sólidas.
Diagramas de fase
Como se utiliza en este texto, el término diagrama de fase es un medio gráfico de representar las fases de un sistema de aleación metálica como una función de la composición y la temperatura. El análisis del diagrama se limitará a sistemas de aleaciones que consisten en dos elementos a presiones atmosféricas. Este tipo de diagrama se denomina diagrama de fase binaria. En otros textos sobre la ciencia de los materiales se estudian otras formas de los diagramas de fase, por ejemplo en la referencia [5].
El sistema de aleación cobre-níquel El modo mejor de presentar el diagrama de fase es con un ejemplo. En la figura 6.2 se ilustra uno de los casos más sencillos, el sistema de la aleación Cu-Ni. En el eje horizontal se grafica la composición, y en el vertical la temperatura. Así, cualquier punto del diagrama indica la composición conjunta y la fase o fases presentes a la temperatura dada. El cobre puro se funde a 1 083 ºC (1 981 ºF), y el níquel puro a 1 455 ºC (2 651 ºF). Las composiciones de la aleación entre estos extremos muestran fusión gradual que comienza en el solidus y en el liquidus conforme la temperatura se incrementa.
Determinación de las composiciones químicas de las fases Aunque la composición conjunta de la aleación está dada por su posición en el eje x, las composiciones de las fases líquida y sólida no son las mismas. Es posible determinar dichas composiciones por medio del diagrama de fase si se dibuja una línea horizontal a partir de la temperatura de interés. Los puntos de la intersección de la línea horizontal con las de solidus y de liquidus indican las composiciones de las fases sólida y líquida presentes, respectivamente. Tan sólo se hacen las proyecciones verticales desde esos puntos de intersección hacia el eje x y se leen las composiciones correspondientes.
Ejemplo 6.1 Determinación de composiciones a partir del diagrama de fase
Para ilustrar el procedimiento, suponga que se desea analizar las composiciones de las fases líquida y sólida presentes en el sistema cobre-níquel, para una composición agregada de 50% de níquel y a una temperatura de 1 260 ºC (2 300 ºF).Solución: Se dibuja una línea horizontal a la temperatura dada, como se muestra en la fi gura 6.2. La línea interseca la de solidus en una composición de 62% de níquel, lo que indica la composición de la fase sólida. La intersección con la línea de liquidus ocurre en una composición de 36% de Ni, que corresponde al análisis de la fase líquida.
Determinación de las cantidades de cada fase A partir del diagrama de fase, también se puede determinar las cantidades de cada fase presentes a una temperatura dada. Esto se hace por medio de la regla de la palanca inversa: 1) sobre la misma línea horizontal de antes, que indica la composición conjunta a una temperatura dada, se mide la distancia entre la composición agregada y los puntos de intersección con las líneas de liquidus y de solidus, y se identifican las distancias como CL y CS, respectivamente (véase de nuevo la figura 6.2), 2) la proporción de fase líquida presente está dada por
Los métodos para determinar las composiciones químicas de las fases y las cantidades en cada una de éstas se aplican tanto a la región sólida del diagrama de fase como a la región liquidus-solidus. Estos métodos pueden emplearse donde sea que haya regiones en el diagrama de fase en que haya dos de ellas presentes. Cuando sólo está presente una fase (véase la figura 6.2, se trata de toda la región sólida) la composición de la fase es su composición agregada en condiciones de equilibrio; y la regla de la palanca inversa no se aplica puesto que sólo hay una fase.
El sistema de la aleación estaño-plomo Un diagrama de fase más complicado es el del sistema Sn-Pb, que se muestra en la figura 6.3. Las aleaciones estaño-plomo se utilizan mucho como material de soldadura (véase la sección 32.2) de conexiones eléctricas. El diagrama de fase presenta varias características que no aparecen en el de Cu-Ni ya visto. Una característica es la presencia de dos fases sólidas, alfa (a) y beta (b). La fase a es una so lu ción sólida de estaño en plomo en el lado izquierdo del diagrama, y la fase b es una solución sólida de plomo en estaño, que ocurre sólo a temperaturas elevadas alrededor de 200 ºC (375 ºF) en el lado derecho del diagrama. Entre esas soluciones sólidas queda una mezcla de las dos fases sólidas, alfa + beta.
Otra característica de interés en el sistema estaño-plomo es la manera en que difiere la fusión para composiciones diferentes. El estaño puro se funde a 232 ºC (449 ºF), y el plomo puro a 327 ºC (621 ºF). Las aleaciones de estos elementos se funden a temperaturas más bajas. El diagrama muestra dos líneas de liquidus que comienzan en los puntos de fusión de los metales puros hasta alcanzar una composición de 61.9% de estaño. Ésta es la composición eutéctica para el sistema estaño-plomo. En general, una aleación eutéctica es una composición particular en un sistema de aleación para la que el solidus y liquidus están a la misma temperatura. La temperatura eutéctica correspondiente, el punto de fusión de la composición eutéctica, es de 183 ºC (362 ºF), en este caso. La temperatura eutéctica siempre es el punto de fusión más bajo para un sistema de aleación (el término eutéctico se deriva de la palabra griega eutektos, que significa que se funde con facilidad).
Los métodos para determinar el análisis químico de las fases y las proporciones de éstas presentes, se aplican con facilidad al sistema Sn-Pb igual que se hizo en el de Cu-Ni. En realidad, esos métodos son aplicables en cualquier región que contenga dos fases, inclusive sólidas. La mayoría de los sistemas de aleación se caracteriza por la existencia de fases sólidas y composiciones eutécticas múltiples, por lo que es frecuente que los diagramas de fase de ellos sean similares al del estaño-plomo. Por supuesto, muchos sistemas de aleación son considerablemente más complejos. Uno de ellos se estudiará más adelante, cuando se vea las aleaciones de hierro y carbono.
METALES FERROSOS
Los metales ferrosos se basan en el hierro, uno de los metales más antiguamente conocidos por el hombre (véase la nota histórica 6.1). Las propiedades y otros datos relacionados con el hierro se presentan en la tabla 6.1a). Los metales ferrosos de importancia en la ingeniería son aleaciones de hierro y carbono. Se dividen en dos grupos principales: acero y hierro fundido. Juntos constituyen aproximadamente el 85% de las toneladas de metal en Estados Unidos [5]. Se comenzará el estudio de los metales ferrosos con el examen del diagrama de fase hierro-carbono.
En la figura 6.4 se presenta el diagrama de fase del hierro-carbono. El hierro puro se funde a 1 539 ºC (2 802 ºF). Durante la elevación de la temperatura a partir de la del ambiente, pasa por varias transformaciones de fase sólida, como se aprecia en el diagrama. Al comenzar a temperatura ambiente la fase es alfa (a), también llamada ferrita. A 912 ºC (1 674 ºF), la ferrita se transforma en gama (g), denominada austenita. Ésta, a su vez, se convierte en delta (d) a 1 394 ºC (2 541 °F), en la que permanece hasta que se funde. Las tres fases son distintas; la alfa y delta tienen estructuras reticulares BCC (véase la sección 2.3), y entre ellas está la gama con FCC. El video clip sobre tratamiento térmico describe el diagrama de fase hierro-carbono y cómo se utiliza para dar resistencia al acero. El hierro, como producto comercial, se encuentra disponible con varios niveles de pureza.
El hierro electrolítico es el más puro, con cerca de 99.99%, se usa en investigación y otros propósitos en los que se requiere al metal puro. El hierro de lingote contiene alrededor de 0.1% de impurezas (inclusive cerca de 0.01% de carbono), y se usa en aplicaciones en las que se necesitan ductilidad o resistencia a la corrosión elevadas. El hierro forjado contiene un 3% de escoria pero muy poco carbono, y se le da forma con facilidad en operaciones de formado en caliente, como la forja.
Los límites de solubilidad del carbono en el hierro son bajos en la fase de ferrita, sólo cerca de 0.022% a 723 ºC (1 333 ºF). En la de austenita puede disolverse cerca de 2.1% de carbono a una temperatura de 1 130 ºC (2 066 ºF). Esta diferencia de solubilidades entre la alfa y la gama origina oportunidades para dar resistencia por medio de tratamiento térmico, pero eso se deja para más adelante. Aun sin tratamiento térmico, la resistencia del hierro se incrementa en forma notable conforme el contenido de carbono aumenta, y se ingresa a la región en la que el metal toma el nombre de acero. Con más precisión, el acero se define como una aleación de hierro-carbono que contiene entre 0.02% y 2.1% de carbono; por supuesto, los aceros también pueden contener otros elementos de aleación.
Además de las fases mencionadas, otra fase es notable en el sistema de la aleación hierro-carbono. Ésta es la del Fe3 C, también llamada de cementita, que es una fase intermedia: un compuesto metálico de hierro y carbono que es duro y frágil. A temperatura ambiente y en condiciones de equilibrio, las aleaciones de hierro-carbono forman un sistema de dos fases con niveles de carbono apenas por arriba de cero. El contenido de carbono de los aceros varía entre esos niveles bajos y cerca de 2.1%. Por arriba de 2.1% de C y hasta 4% o 5%, la aleación se define como hierro colado.
Producción de hierro y acero
Este estudio de la producción de hierro y acero comienza con los yacimientos de mineral de hierro y otras materias primas que se requieren. Después se estudia la producción de hierro, en la que éste se reduce de los minerales, y la fabricación de acero, en la que se refina para obtener la pureza y composición (aleación) que se desean. Luego se consideran los procesos de fundición que se efectúan en la acería.Yacimientos* de hierro y otras materias primas El mineral principal que se usa para producir hierro y acero es la hematita (Fe2 O3 ). Otros minerales de hierro son la magnetita (Fe3 O4 ), siderita (FeCO3 ) y la limonita (Fe2 O3 -xH2 O) donde el valor de x es de alrededor de 1.5). Los yacimientos de hierro contienen de 50% a alrededor de 70% de hierro, en función de su ley** (la hematita contiene casi 70% de hierro). Además, hoy día se utilizan mucho los desechos de hierro y acero para producir hierro y acero.
Otras materias primas necesarias para reducir hierro de las menas son el coque y la roca caliza. El coque es un combustible de carbono alto que se produce por medio de calentar durante varias horas carbón bituminoso en una atmósfera escasa en oxígeno, para luego rociarle agua en torres de enfriamiento especiales. El coque desempeña dos funciones en el proceso de reducción: 1) es un combustible que suministra el calor para las reacciones químicas, y 2) produce monóxido de carbono (CO) para reducir el mineral de hierro. La caliza es una roca que contiene proporciones grandes de carbonato de calcio (CaCO3 ). La caliza se utiliza en el proceso como fundente con el cual reaccionar y retirar las impurezas tales como escoria del hierro fundido.
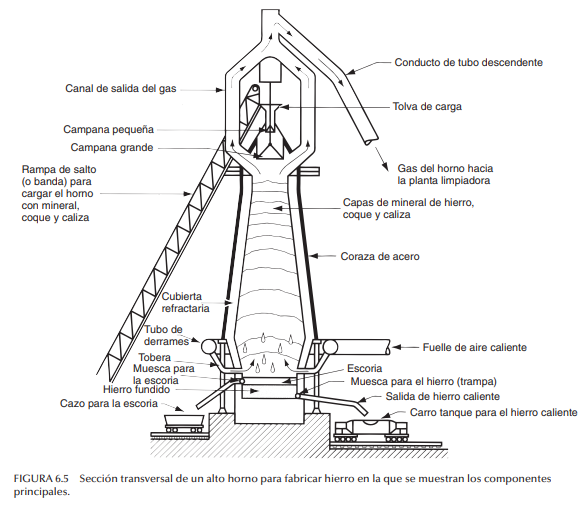
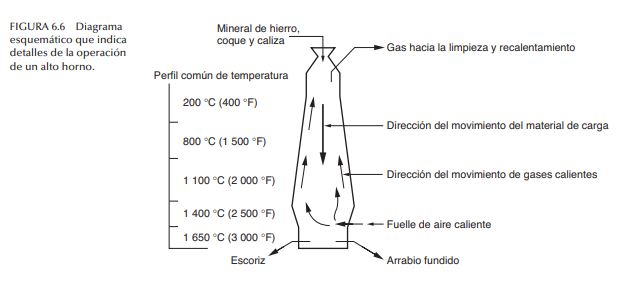
Fabricación de hierro Para producir hierro, se coloca una carga de mineral, coque y caliza en la parte superior de un alto horno. Un alto horno es una cámara refractaria recta con diámetro de 9 a 11 m (30 a 35 ft) en su parte más ancha, y altura de 40 m (125 ft), en el que se fuerzan gases calientes dentro de la parte baja de la cámara a tasas elevadas para llevar a cabo la combustión y reducción del hierro. En las figuras 6.5 y 6.6 se ilustra un alto horno común y algunos de sus detalles técnicos. La carga desciende con lentitud desde la parte superior del horno hacia su base y se calienta a temperaturas de alrededor de 1 650 ºC (3 000 ºF). La combustión del coque se lleva a cabo con gases calientes (CO, H2 , CO2 , H2 O, N2 , O2 y combustibles) que pasan hacia arriba a través de las capas de la carga de material. El gas CO tiene un efecto reductor en el mineral de hierro; la reacción (simplificada) se escribe como sigue (se usa hematita como el mineral de inicio):
Fe2
O3 + CO → 2FeO + CO2
CO2 + C(coque) → 2CO
FeO + CO → Fe + CO2
El papel que juega la caliza se resume como sigue. En primer lugar, la caliza se reduce a cal (CaO) por calentamiento, así:
CaCO3 → CaO + CO2
Es instructivo notar que se requieren aproximadamente siete toneladas de materias primas para producir una tonelada de hierro. Las proporciones de los ingredientes son las siguientes: 2.0 ton de mineral de hierro, 1.0 ton de coque, 0.5 ton de caliza, y (aquí la estadística es sorprendente) 3.5 ton de gases. Una proporción significativa de los subproductos se recicla.
El hierro colectado en la base del alto horno llamado hierro de primera fundición (arrabio) contiene más del 4% de C, más otras impurezas: 0.3%−1.3% de Si, 0.5−2.0% de Mn, 0.1−1.0% de P, y 0.02−0.08% de S [9]. Se requiere más refinación del metal para obtener tanto hierro fundido como acero. Para convertir el arrabio en hierro fundido gris es común emplear un horno llamado cubilote (véase la sección 11.4.1). Para el acero, las composiciones deben controlarse estrechamente y las impurezas llevarse a niveles mucho más bajos.
Fabricación de acero Desde la mitad del siglo XIX, se han inventado cierto número de pro cesos para refinar hierro de primera fundición y obtener acero. Hoy día, los dos más importantes son el horno de oxígeno básico (BOF) y el eléctrico. Ambos se emplean para producir aceros al carbono y aleados.
El horno de oxígeno básico produce alrededor del 70% del acero de Estados Unidos. El BOF es una adaptación del convertidor Bessemer. Mientras que el proceso Bessemer utiliza aire que pasa a través del arrabio fundido para quemar las impurezas, el proceso de oxígeno básico utiliza oxígeno puro. En la figura 6.7 se presenta un diagrama del BOF convencional durante la mitad de una colada. El recipiente común del BOF mide cerca de 5 m (16 ft) de diámetro interno y procesa de 150 a 200 toneladas en una sola colada.
En la figura 6.8 se muestra la secuencia para fabricar acero en un BOF. En las plantas siderúrgicas integradas se transfiere el arrabio desde el alto horno al BOF en carros de ferrocarril llamados carros cuchara de hierro caliente. En la práctica moderna, al hierro fundido se agrega chatarra de acero por cerca del 30% de una carga normal del BOF. También se agrega cal (CaO). Después de la carga, se inserta la lanceta en el recipiente de modo que su punta se encuentre a 1.5 m (5 ft) por arriba de la superficie del hierro fundido. Se sopla O2 a alta velocidad desde la lanceta, lo que provoca combustión y calentamiento en la superficie del recipiente del metal fundido. El carbono disuelto en el hierro y otras impurezas tales como silicio, manganeso y fósforo se oxidan. Las reacciones son
Los gases de CO y CO2 que se producen en la primera reacción, escapan a través de la boca del recipiente del BOF y se captan en la campana de emisiones; los productos de las otras tres reacciones se retiran como escoria, con el uso de cal como elemento fundente. Durante el proceso, el contenido de C en el hierro disminuye en forma casi lineal con el tiempo, lo que permite un control muy predecible de los niveles de carbono en el acero. Después de refinarlo al nivel que se desea, el acero fundido se extrae; a la colada se vierten ingredientes de aleación y otros aditivos; después se extrae la escoria. En 20 min es posible procesar una colada de 200 ton de acero, aunque el ciclo completo (tiempo desde la introducción hasta la extracción) toma 45 min, aproximadamente.
Los avances recientes de la tecnología del proceso de oxígeno básico incluyen el uso de boquillas en fondo del recipiente, a través de las cuales se inyecta oxígeno en el hierro fundido. Con esto se logra una mejor mezcla que con la lanceta BOF convencional, lo que da como resultado tiempos más cortos de procesamiento (una reducción de cerca de 3 min), menor contenido de carbono y producciones más grandes.
El horno de arco eléctrico produce alrededor del 30% del acero de Estados Unidos. Aunque originalmente se usaba arrabio como la carga para este tipo de horno, hoy día las materias primas principales son chatarra de hierro y de acero. Los hornos de arco eléctrico se encuentran disponibles en varios diseños; el tipo de arco directo que se muestra en la figura 6.9 es el más económico actualmente. Estos hornos tienen cubiertas removibles para cargarlos desde arriba; la extracción se lleva a cabo por medio de la inclinación del horno com pleto. En el horno se carga chatarra de hierro y de acero seleccionadas por sus composiciones, junto con ingredientes de aleación y caliza (fundente), y se calientan por medio de un arco eléctrico que va de grandes electrodos a la carga de metal. La fundición total requiere cerca de 2 horas; el tiempo de introducción a extracción es de 4 horas. Es común que las capacidades de los hornos eléctricos varíen entre 25 y 100 toneladas por colada. Los hornos de arco eléctrico destacan por la mejor calidad del acero pero su costo por tonelada producida es mayor, en comparación con el del BOF. Por lo general, el horno de arco eléctrico se asocia con la producción de aceros de aleación, aceros para herramientas y aceros inoxidables.
Fundición de lingotes Los aceros producidos por hornos BOF o eléctricos se solidifican para procesarlos posteriormente, ya sea como lingotes fundidos o por fundición continua. Los lingotes de acero son fundiciones discretas y grandes que pesan menos desde 1 ton hasta 300 ton (el peso de la colada total). Los moldes de los lingotes están hechos de hierro al alto carbono y están abiertos arriba o abajo para retirar la colada solidificada. En la figura 6.10 se ilustra un molde de fondo amplio. La sección transversal puede ser cuadrada, rectangular o redonda, y su perímetro por lo general es corrugado para incrementar el área superficial a fin de que se enfríe más rápido. El molde se coloca en una plataforma denominada banco escabel; después de solidificarse, el molde se eleva, y deja la fundición sobre el banco.
Fundición o colada continua La fundición o colada continua se aplica mucho en la producción de aluminio y cobre, pero es mucho más destacada en la de acero. El proceso consiste en remplazar los lingotes fundidos porque la productividad se incrementa en forma notable. La fundición de lingotes es un proceso discreto. Como los moldes son relativamente grandes, el tiempo de solidificación es significativo. El tiempo para que se solidifique un lingote grande de acero puede ser de 10 a 12 horas. El uso de un fundido continuo reduce el tiempo de solidificación en un orden de magnitud.
El proceso de fundición continua, también llamado fundición de filamento, se ilustra en la figura 6.11. El acero fundido se vierte desde un recipiente hacia un contenedor temporal llamado cacerola, que dosifica el metal hacia uno o más moldes de fundición continua. El acero comienza a solidificarse en las regiones exteriores conforme viaja hacia abajo a través del molde enfriado por agua. Un rocío de agua acelera el proceso de enfriamiento. Mientras está caliente y es plástico, el metal se cambia de orientación vertical a horizontal. Entonces se corta en secciones o se alimenta en forma continua a un laminador (véase la sección 21.1) en el que se le da forma de lámina o bloque de acero u otras secciones transversales.
Aceros
El acero es una aleación de hierro que tiene un contenido de carbono que varía entre 0.02% y 2.11%. Es frecuente que también incluya otros ingredientes de aleación: manganeso, cromo, níquel y molibdeno; pero es el contenido de carbono lo que convierte al hierro en acero. Existen cientos de composiciones de acero disponibles en el comercio. Aquí, para propósitos de organización se agrupan en las categorías siguientes: 1) aceros al carbón simples, 2) aceros bajos de aleación, 3) aceros inoxidables y 4) aceros para herramientas.
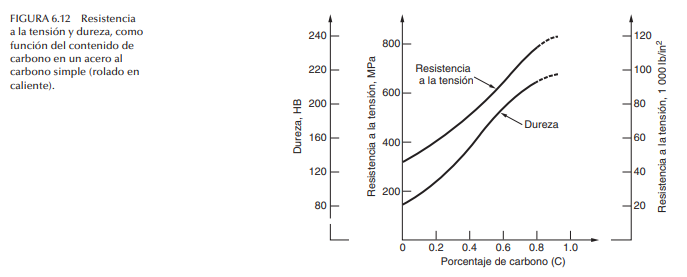
Aceros al carbono Estos aceros contienen carbono como elemento principal de la aleación, y sólo pequeñas cantidades de otros elementos (lo normal es alrededor de 0.5% de manganeso). La resistencia de los aceros simples al carbono se incrementa con el contenido de éste; en la figura 6.12 se presenta una gráfica común de esa relación.
De acuerdo con un esquema de nomenclatura creado por el American Iron and Steel Institute (AISI) y la Society of Automotive Engineers (SAE), los aceros simples al carbono se especifican por medio de un sistema numérico de cuatro dígitos: 10XX, donde el 10 indica que el acero es al carbono simple, y XX señala el porcentaje de carbono en centésimas de puntos porcentuales. Por ejemplo, un acero 1020 contiene 0.20% de C. Es común que los aceros simples al carbono se clasifiquen en tres grupos, de acuerdo con su contenido de carbono:
2. Aceros al medio carbono. Su contenido de carbono varía entre 0.20% y 0.50%, y se espe cifican para aplicaciones que requieren una resistencia mayor que las de los aceros al bajo carbono. Las aplicaciones incluyen componentes de maquinaria y piezas de motores tales como cigüeñales y rodillos de transmisión.
3. Aceros al alto carbono. Contienen carbono en cantidades superiores a 0.50% y se especifican para aplicaciones que necesitan resistencias aún mayores y también rigidez y dureza. Algunos ejemplos son resortes, herramientas y hojas de corte y piezas resistentes al desgaste
Aceros de baja aleación Son aleaciones de hierro−carbono que contienen elementos adicionales en cantidades que totalizan menos de 5% del peso. Debido a estas adiciones, los aceros de baja aleación tienen propiedades mecánicas superiores a las de los simples al carbono para aplicaciones dadas. Las propiedades superiores por lo general significan más resistencia, dureza, dureza en caliente, resistencia al desgaste, tenacidad y combinaciones más deseables de éstas. Es frecuente que se requiera tratamiento térmico para lograr propiedades mejoradas.
Los elementos comunes de aleación que se agregan al acero son cromo, manganeso, molibdeno, níquel y vanadio, a veces en forma individual pero por lo general en combinacio nes. Es frecuente que estos elementos formen soluciones sólidas con hierro y compuestos metálicos con carbono (carburos), lo que supone que hay suficiente carbono presente para efectuar la reacción. Los efectos de los ingredientes principales de la aleación se resumen como sigue:
➣ El cromo (Cr) mejora la resistencia, dureza, resistencia al desgaste y dureza en caliente. Es uno de los ingredientes de aleación más eficaces para incrementar la templabilidad (véase la sección 27.2.3). En proporciones significativas, el Cr mejora la resistencia a la corrosión.➣ El manganeso (Mn) mejora la resistencia y dureza del acero. Cuando éste se encuentra caliente, la templabilidad mejora con el aumento de manganeso. Debido a estos beneficios, el manganeso es un ingrediente que se usa mucho en las aleaciones de acero.➣ El molibdeno (Mo) incrementa la tenacidad y dureza en caliente. También mejora la templabilidad y forma carburos que dan resistencia al desgaste.➣ El níquel (Ni) mejora la resistencia y la tenacidad. Incrementa la dureza pero no tanto como los otros elementos de las aleaciones del acero. En cantidades significativas mejora la resistencia a la corrosión y es el otro ingrediente principal (además del cromo) de ciertos tipos de acero inoxidable.
➣ El vanadio (V) inhibe el crecimiento de granos durante el procesamiento a temperaturas elevadas, lo cual mejora la resistencia y tenacidad del acero. También forma carburos que incrementan la resistencia al desgaste.
En la tabla 6.2 se presentan las designaciones AISI-SAE de muchos aceros de baja aleación, las que indican el análisis químico nominal. Como antes, el contenido del carbono está especificado por el término XX expresado en 1/100% de carbono. Para que esté completa, se incluyen aceros al carbono (10XX). Para dar una idea de las propiedades que tienen algunos de estos aceros, se compiló la tabla 6.3, que enlista el tratamiento a que se sujeta el acero para darle fortalecimiento a su resistencia y ductilidad.
Los aceros de baja aleación no sueldan con facilidad, en especial con niveles de carbono medios y altos. Desde la década de 1960 la investigación ha estado dirigida al desarrollo de aceros al bajo carbono y baja aleación, que tengan razones mejores de resistencia/peso que los aceros al carbono simples, pero que suelden mejor que los de baja aleación. Los productos creados a partir de esos trabajos son los aceros de alta resistencia y baja aleación (HSLA). Por lo general tienen un contenido bajo de carbono (en el rango de 0.10 a 0.30% de C) más cantidades relativamente pequeñas de ingredientes de aleación (generalmente alrededor del 3% del total, de elementos tales como Mn, Cu, Ni y Cr). Los aceros HSLA están rolados en caliente en condiciones controladas diseñadas para proporcionar mejor resistencia en comparación con los aceros simples al carbono, pero sin sacrificar la facilidad de darles forma o soldarlos. La resistencia se les da por medio de una aleación de solución sólida: el tratamiento térmico no es factible debido a su bajo contenido de carbono. En la tabla 6.3 se enlista un acero HSLA, junto con sus propiedades (la química es: 0.12 C, 0.60 Mn, 1.1 Ni, 1.1 Cr, 0.35 Mo y 0.4 Si).
Aceros inoxidables Los aceros inoxidables constituyen un grupo de aceros altamente aleados diseñados para proporcionar gran resistencia a la corrosión. El elemento principal de la aleación del acero inoxidable es el cromo, por lo general arriba del 15%. El cromo de la aleación forma una película de óxido impermeable, delgada, que en una atmósfera oxidante protege a la superficie de la corrosión. El níquel es otro ingrediente de aleación que se emplea en ciertos aceros inoxidables para incrementar la protección contra la corrosión. El carbono se utiliza para dar resistencia y endurecer el metal; sin embargo, el contenido creciente de carbono tiene el efecto de reducir la protección contra la corrosión debido a que el carburo de cromo se forma para reducir la cantidad de Cr disponible en la aleación.
Aceros inoxidables Los aceros inoxidables constituyen un grupo de aceros altamente aleados diseñados para proporcionar gran resistencia a la corrosión. El elemento principal de la aleación del acero inoxidable es el cromo, por lo general arriba del 15%. El cromo de la aleación forma una película de óxido impermeable, delgada, que en una atmósfera oxidante protege a la superficie de la corrosión. El níquel es otro ingrediente de aleación que se emplea en ciertos aceros inoxidables para incrementar la protección contra la corrosión. El carbono se utiliza para dar resistencia y endurecer el metal; sin embargo, el contenido creciente de carbono tiene el efecto de reducir la protección contra la corrosión debido a que el carburo de cromo se forma para reducir la cantidad de Cr disponible en la aleación.
Los aceros inoxidables se dividen por tradición en tres grupos que reciben su nombre por la fase predominante presente en la aleación a temperatura ambiente:
1. Inoxidables austeníticos. Su composición normal es de alrededor de 18% de Cr y 8% de Ni, y son los más resistentes a la corrosión de los tres grupos. Debido a esa composición, a veces se les identifica como inoxidables 18-8. No son magnéticos y son muy dúctiles, pero muestran un endurecimiento por trabajo significativo. El níquel tiene el efecto de agrandar la región austenítica en el diagrama de fase de hierro-carbono, lo que los hace estables a temperatura ambiente. Los aceros inoxidables austeníticos se emplean para fabricar equipo de procesamiento químico y de alimentos, así como piezas de maquinaria que requieren alta resistencia a la corrosión.2. Inoxidables ferríticos. Contienen de 15% a 20% de cromo, poco carbono y nada de níquel. Esto produce una fase de ferrita a temperatura ambiente. Los aceros inoxidables ferríticos son magnéticos y menos dúctiles y resistentes a la corrosión que los austeníticos. Las piezas fabricadas con ellos van desde utensilios de cocina hasta componentes de motores a reacción.3. Inoxidables martensíticos. Tienen un contenido de carbono más elevado que los ferríticos, lo que permite que se les dé resistencia por medio de tratamiento térmico (véase la sección 27.2). Tienen hasta 18% de Cr pero nada de Ni. Son fuertes, duros y resistentes a la fatiga, pero por lo general no tan resistentes a la corrosión como los de los otros dos grupos. Los productos más comunes incluyen instrumentos de corte y quirúrgicos. La mayor parte de aceros inoxidables reciben su nombre con un esquema de numeración de la AISI, de tres dígitos. El primero indica el tipo general y los últimos dos dan el grado específico dentro del tipo. La tabla 6.4 enlista los aceros inoxidables más comunes con sus composiciones normales y propiedades mecánicas.
Los aceros inoxidables tradicionales se crearon a principios del siglo XX. Desde entonces, se han creado varias aleaciones de acero que tienen buena resistencia a la corrosión y otras propiedades deseables. Éstas también se clasifican como aceros inoxidables; la lista continúa así:4. Aceros inoxidables de precipitación. Tienen una composición química típica de 17% de Cr y 7% de Ni, con cantidades pequeñas adicionales de elementos de aleación tales como aluminio, cobre, titanio y molibdeno. La característica que los distingue del resto de los inoxidables es que pueden fortalecerse por medio de endurecimiento por precipitación (véase la sección 27.3). A temperaturas elevadas mantienen su fuerza y resistencia a la corrosión, lo que hace que estas aleaciones sean apropiadas para aplicaciones aeroespaciales.5. Inoxidables dúplex. Poseen una estructura que es una mezcla de austenita y ferrita en cantidades aproximadamente iguales. Su resistencia a la corrosión es similar a los grados austeníticos y muestran resistencia mejorada al agrietamiento por esfuerzo-corrosión. Las aplicaciones incluyen intercambiadores de calor, bombas y plantas de tratamiento de aguas residuales.
Aceros para herramientas Los aceros para herramientas son una clase (por lo general)
altamente aleada diseñada para su uso en herramientas de corte industriales, troqueles y
moldes. Para desempeñarse en esas aplicaciones deben poseer resistencia elevada, dureza,
dureza en caliente, resistencia al desgaste y tenacidad a los impactos. Para obtener estas
propiedades los aceros para herramienta se tratan térmicamente. Las razones principales
para los niveles altos de elementos de aleación son: 1) dureza mejorada, 2) distorsión
reducida durante el tratamiento con calor, 3) dureza en caliente, 4) formación de carburos
metálicos duros para que sean resistentes a la abrasión, y 5) tenacidad mejorada.
Los aceros para herramientas se dividen en tipos de acuerdo con la aplicación y composición. La AISI utiliza un esquema de clasificación que incluye un prefijo de una letra
para identificar el acero para herramienta. En la lista de la tabla 6.5 que sigue, se mencionan esos tipos de acero, se identifica el prefijo y se presentan algunas composiciones
comunes.
T, M Aceros para herramientas de alta velocidad. Se usan como herramientas de corte en procesos de maquinado (véase la sección 23.22). Se formulan para que tengan gran resistencia al desgaste y dureza en caliente. Los aceros de alta velocidad originales (HSS) se crearon alrededor de 1900. Permitieron incrementos muy grandes en la velocidad de corte en comparación con herramientas que se usaban con anterioridad; de ahí su nombre. Las dos designaciones AISI indican el elemento principal de la aleación: T por el tungsteno y M por el molibdeno.
H Aceros de herramientas para trabajos en caliente. Están pensados para usarse con troqueles de trabajos en caliente para forjado, extrusión y moldes para fundición.
D Aceros de herramientas para trabajos en frío. Son aceros para troqueles que se emplean en operaciones de trabajo en frío, tales como moldear láminas metálicas, extrusión en frío y ciertas operaciones de forja. La designación D es por dado (die). Se relacionan de cerca con las designaciones de AISI A y O, que son para endurecimiento con aire (air) y aceite (oil). Proporcionan buena resistencia al desgaste y una distorsión baja.
W Aceros para herramienta de endurecimiento por agua. Tienen contenido elevado de carbono con poco o nada de otros elementos de aleación. Sólo pueden endurecerse por enfriamiento por inmersión rápido en agua. Se emplean mucho debido a su bajo costo, pero se limitan a aplicaciones de temperatura baja. Una aplicación común son los troqueles de cabezales en frío.
S Aceros de herramientas resistentes a los golpes. Están hechos para usarse en aplicaciones en las que se requiere mucha tenacidad, como en muchos cortes de lámina metálica, punzonado y operaciones de doblado.
P Aceros para moldes. Se utilizan para fabricar moldes para plásticos y caucho.
L Aceros para herramientas de baja aleación. Por lo general se reservan para aplicaciones especiales.
Los aceros para herramientas no son los únicos materiales para ellas. Los aceros al carbono, de baja aleación e inoxidables se emplean para muchas aplicaciones de herramientas y troqueles. Los hierros colados y ciertas aleaciones no ferrosas también son apropiados para algunas aplicaciones de herramientas. Además, varios materiales cerámicos (por ejemplo, Al2 O3 ) se usan como inserciones cortantes de alta velocidad, abrasivos y otro tipo de herramientas.
Hierros colados
El hierro colado es una aleación de hierro que contiene de 2.1% a 4% de carbono, y de 1% a 3% de silicio. Su composición lo hace muy apropiado como metal de fundición. En realidad, el peso en toneladas de los artículos de hierro colado es varias veces el de todas las demás piezas de metales fundidos combinados (con excepción de los lingotes que se fabrican durante la producción de acero y que posteriormente son rolados en forma de barras, láminas y otras formas similares). El peso total en toneladas del hierro colado ocupa el segundo lugar, pero sólo con respecto al acero entre todos los metales.
Entre los diversos tipos de hierro colado, el más importante es el gris. Otros tipos incluyen el hierro dúctil, el hierro colado blanco, el hierro maleable y varios hierros colados de aleaciones. Las composiciones comunes de los hierros colados gris y blanco se muestran en la figura 6.13, donde se indica su relación con el acero fundido. Los hierros dúctiles y los maleables poseen químicas similares a las de los hierros gris y blanco, respectivamente, pero resultan de tratamientos especiales que se describirán más adelante. En la tabla 6.6 se presenta una lista de las composiciones químicas de los tipos principales, así como de sus propiedades mecánicas.
Hierro colado gris Éste tiene el tonelaje mayor entre los hierros colados. Tiene una com posición que va de 2.5% a 4% de carbono y de 1% a 3% de silicio. Esta química da como resultado la formación de escamas de grafito (carbono) distribuidas en todo el cuerpo fundido hasta que se solidifica. La estructura ocasiona que la superficie del metal adquiera un color gris cuando se fractura, de donde adquiere su nombre. La dispersión de las escamas de grafito es responsable de dos propiedades atractivas: 1) buen amortiguamiento a la vibración, que es deseable en los motores y otra clase de maquinaria, y 2) cualidades de lubricación interna, lo que hace maquinable al metal fundido.
Hierro dúctil Este es un hierro con la composición del gris en el que el metal fundido recibe tratamiento químico antes de vaciarlo para ocasionar la formación de esferoides de grafito en lugar de escamas. Esto da como resultado un hierro más dúctil y fuerte, de ahí su nombre. Las aplicaciones incluyen componentes de maquinaria que requieren resistencia elevada y buena resistencia al desgaste.
Hierro colado blanco Este hierro colado tiene menos carbono y silicio que el gris. Se forma por un enfriamiento más rápido del metal fundido después del vertido, lo que hace que el carbono permanezca en combinación química con el hierro en forma de cementita (Fe3 C), en vez de precipitarse de la solución en forma de escamas. Cuando se fractura, la superficie adquiere una apariencia cristalina blanca que le da su nombre al hierro. Debido a la cementita, el hierro fundido blanco es duro y frágil, y su resistencia al desgaste es excelente. La resistencia es buena, con un valor común de TS de 276 MPa (40 000 lb/in2 ). Estas propiedades hacen que el hierro colado blanco sea apropiado para aplicaciones en las que se requiere resistencia al desgaste. Un buen ejemplo son las zapatas de los frenos de un ferrocarril.
Hierro maleable Cuando las piezas fundidas de hierro colado blanco se tratan térmicamen te para separar el carbono de la solución y formar agregados de grafito, el metal que resulta se llama hierro maleable. La microestructura nueva posee ductilidad sustancial (hasta 20% de elongación), una diferencia significativa con el metal a partir del cual se transformó. Los productos comunes hechos de hierro colado maleable, incluyen ajustes y bisagras para tubos, ciertos componentes de máquina y piezas de equipo ferroviario.
Hierros de aleaciones fundidas Los hierros colados pueden estar aleados para buscar propiedades y aplicaciones especiales. Estas aleaciones de hierro colado se clasifican como sigue: 1) tipos tratables térmicamente que pueden endurecerse por medio de la formación de martensita; 2) tipos resistentes a la corrosión, cuyos elementos de aleación incluyen níquel y cromo, y 3) tipos resistentes al calor que contienen proporciones elevadas de níquel para tener dureza en caliente y resistencia a la oxidación por alta temperatura.
METALES NO FERROSOS
Los metales no ferrosos incluyen elementos y aleaciones metálicas que no se basan en el hierro. Los metales más importantes de la ingeniería en el grupo de los no ferrosos son el aluminio, el cobre, el magnesio, el níquel, el titanio y el zinc, así como sus aleaciones.Aunque los metales no ferrosos como grupo no igualan la resistencia de los aceros, ciertas aleaciones no ferrosas tienen resistencia a la corrosión o relaciones resistencia/peso que las hacen competitivas ante los aceros para aplicaciones con esfuerzos moderados a altos. Además, muchos de los metales no ferrosos tienen propiedades adicionales a las mecánicas que los hacen ideales para aplicaciones en las que el acero sería inapropiado. Por ejemplo, el cobre tiene una de las resistividades más bajas entre los metales, y se usa ampliamente para fabricar conductores eléctricos. El aluminio es un conductor térmico excelente, y sus aplicaciones incluyen intercambiadores de calor y trastos de cocina. También es uno de los metales a los que se le da forma con mayor facilidad y por esa razón se le valora mucho. El zinc tiene un punto de fusión relativamente bajo, por lo que se le utiliza de manera amplia en las operaciones de fundición a troquel. Los metales no ferrosos comunes tienen su propia combinación de propiedades que los hacen atractivos para una variedad de aplicaciones. En las siguientes nueve secciones se estudian aquellos que son los más importantes en lo comercial y tecnológico.
El aluminio y el magnesio son metales ligeros y por esta característica es frecuente que se les especifique en aplicaciones de ingeniería. Ambos elementos abundan en nuestro planeta, el aluminio en la tierra y el magnesio en el mar, aunque ninguno se extrae con facilidad de su estado natural.
En la tabla 6.1b) se enlistan las propiedades y otros datos del aluminio. Entre los metales principales es un recién llegado relativamente hablando, pues data apenas de fines del siglo XIX (véase la nota histórica 6.2). El estudio en esta sección incluye lo siguiente: 1) una descripción breve de la forma en que se produce el aluminio, y 2) un análisis de las propiedades y sistema de nomenclatura para el metal y sus aleaciones.
Producción de aluminio El mineral principal de aluminio es la bauxita, que consiste por mucho en óxido de aluminio hidratado (Al2 O3 -H2 O) y otros óxidos. La extracción del aluminio a partir de la bauxita se resume en tres pasos: 1) lavado y trituración del mineral para obtener polvos finos; 2) proceso Bayer, en el que la bauxita se convierte en alúmina pura (Al2 O3 ); y 3) electrólisis, en el que la alúmina se separa en aluminio y oxígeno gaseoso (O2 ). El proceso Bayer, llamado así en honor del químico alemán que lo creó, involucra una solución de polvo de bauxita en sosa cáustica acuosa (NaOH) a presión, seguida de precipitación de Al2 O3 puro de la solución. La alúmina es importante en el comercio por sí misma, como material cerámico de uso en la ingeniería
El sistema de nomenclatura para el aluminio es un código numérico de cuatro dígitos. El sistema tiene dos partes, una para el aluminio forjado y otra para los aluminios fundidos. La diferencia es que para estos últimos se emplea un punto decimal después del tercer dígito. En la tabla 6.7a) se presentan las designaciones.
Debido a que en las propiedades de las aleaciones de aluminio influyen mucho el endurecimiento por trabajo y el tratamiento térmico, además del código de composición, debe designarse el templado (tratamiento para dar resistencia, si lo hubiera). En la tabla 6.7b) se presentan las designaciones principales de templado. Esta designación se agrega al número precedente de cuatro dígitos, separado por un símbolo como superíndice, para indicar el tratamiento o la ausencia de él; por ejemplo, 1 060 °F. Por supuesto, los tratamientos de templado que especifican endurecimiento por deformación no se aplican a las aleaciones fundidas. En la tabla 6.8 se dan algunos ejemplos de las diferencias notables en las propiedades mecánicas de las aleaciones de aluminio que resultan de los distintos tratamientos.
El magnesio y sus aleaciones
El magnesio (Mg) es el más ligero de los metales estructurales. Su gravedad específica y otros datos básicos se presentan en la tabla 6.1c). El magnesio y sus aleaciones se encuentran disponibles tanto en forma forjada como fundida. Es relativamente fácil de maquinar. Sin embargo, en todo procesamiento del magnesio, las partículas pequeñas del metal (tales como astillas metálicas pequeñas procedentes del corte) se oxidan con rapidez, por lo que debe tenerse cuidado para evitar el peligro de incendio.
Propiedades y esquema de nomenclatura Como metal puro, el magnesio es relativamente suave y carece de la resistencia suficiente para la mayor parte de las aplicaciones de la ingeniería. Sin embargo, se puede alear y tratar térmicamente para que alcance resistencias comparables a las de las aleaciones del aluminio. En particular, su relación resistencia-peso es una ventaja en los aviones y componentes de misiles.
El esquema de nomenclatura del magnesio usa un código alfanumérico de tres a cinco caracteres. Los primeros dos son letras que identifican los elementos principales de la aleación (pueden especificarse hasta dos elementos en el código, en orden decreciente de porcentaje, o en forma alfabética si los porcentajes son iguales). En la tabla 6.9 se enlistan dichas letras del código. Las letras van seguidas de un número de dos dígitos que indican, respectivamente, las cantidades de dos ingredientes de aleación al porcentaje más cercano. Finalmente, el último símbolo es una letra que indica cierta variación en la composición, o tan sólo el orden cronológico en el que se estandarizó para su disponibilidad comercial. Las aleaciones de magnesio también requieren la especificación del templado, y para ellas se emplea el mismo esquema básico que para el aluminio que se presentó en la tabla 6.7b).
En la tabla 6.10 se dan algunos ejemplos de aleaciones de magnesio, que ilustran el esquema de nomenclatura e indican su resistencia a la tensión y ductilidad.
El cobre y sus aleaciones
El cobre (Cu) es uno de los metales más antiguos que se conocen (véase la nota histórica 6.3). Los datos básicos del elemento cobre se presentan en la tabla 6.1d).
Producción de cobre En los tiempos antiguos, el cobre existía en la naturaleza como elemento libre. Hoy día, esos depósitos naturales son más difíciles de encontrar y el metal se extrae de minerales que en su mayoría son sulfuros, como la calcopirita (CuFeS2 ). El mine ral se tritura (véase la sección 17.1.1), se concentra por flotación y después se aparta (se derrite o funde, con frecuencia con una reacción química para separar el metal del mineral). El cobre resultante se denomina cobre ampollado, que tiene una pureza de 98% y 99%. Se emplea electrólisis para obtener niveles de pureza más elevados apropiados para el uso comercial.
Propiedades y esquema de nomenclatura El cobre puro tiene un color rojizo o rosa distintivo, pero su propiedad de ingeniería más notable es su resistividad eléctrica baja, uno de los elementos con la más baja. Debido a esta propiedad, y a su abundancia relativa en la naturaleza, el cobre puro comercial se usa mucho como conductor eléctrico (aquí se debe decir que la conductividad del cobre disminuye de manera significativa si se agregan elementos de aleación). El Cu también es un conductor térmico excelente. El cobre es uno de los metales nobles (el oro y la plata también lo son), por lo que es resistente a la corrosión. Todas esas propiedades se combinan para que el cobre sea uno de los metales más importantes.
En contraparte, la resistencia y dureza del cobre son relativamente bajas, en especial si se toma en cuenta el peso. En consecuencia, para mejorar la resistencia (así como por otras razones), es frecuente que el cobre se alee. El bronce es una aleación de cobre y estaño (es común el 90% de Cu y 10% de Sn), que hoy se usa todavía a pesar de su antigüedad. Se han desarrollado aleaciones de bronce adicionales, con base en otros elementos distintos del estaño; entre éstos se hallan bronces de aluminio, y bronces de silicio. El latón es otra aleación de cobre que resulta familiar, compuesta de cobre y zinc (es común que contenga 65% de cobre y 35% de zinc). La aleación de cobre con mayor resistencia es la del berilio-cobre (con sólo el 2% de berilio). Puede tratarse térmicamente para obtener resistencias a la tensión de 1 035 MPa (150 000 lb/in2 ). Las aleaciones de Be-Cu se usan para hacer resortes.
La nomenclatura de las aleaciones de cobre se basa en el Unified Numbering System for Metals and Alloys (UNS), que emplea un número de cinco dígitos precedido de la letra C (de cobre). Las aleaciones se procesan en formas fraguadas y fundidas, y el sistema de nomenclatura incluye ambas. En la tabla 6.11 se presentan algunas aleaciones de cobre con sus composiciones y propiedades mecánicas.
En muchos aspectos, el níquel (Ni) es similar al hierro. Es magnético y su módulo de elasticidad es virtualmente el mismo que el del hierro y el acero. Sin embargo, es mucho más resistente a la corrosión y las propiedades de alta temperatura de sus aleaciones por lo ge neral son superiores. Debido a sus características de resistencia a la corrosión, se usa mucho como elemento de aleación en el acero, como en los aceros inoxidables, y como metal de recubrimiento de otros metales, como el acero al carbono.
Producción de níquel El mineral de níquel más importante es la pentlandita ((Ni, Fe)9 S8 ). Para extraer el níquel, primero se tritura el mineral mezclado con agua. A fin de separar los sulfuros de los demás minerales de la mena se utilizan técnicas de flotación. Después, se calienta el sulfuro de níquel para quemar algo del azufre, y luego se funde con el fin de eliminar hierro y silicio. Se refina más en un convertidor del tipo Bessemer para obtener sulfuro de níquel (NiS) de alta concentración. Después se aplica electrólisis para recuperar níquel de alta pureza a partir del compuesto. En ocasiones, los minerales de níquel se mezclan con otros de cobre, en cuyo caso la técnica de recuperación que se acaba de describir también produce cobre.
Aleaciones de níquel Las aleaciones de níquel tienen importancia comercial por sí mismas, y son notables por su resistencia a la corrosión y desempeño a altas temperaturas. En la tabla 6.12 se dan la composición, resistencia a la tensión y ductilidad de algunas aleaciones de níquel. Además, cierto número de superaleaciones se basan en el níquel.
El titanio (Ti) es abundante en la naturaleza, constituye cerca del 1% de la corteza terrestre (el 8% corresponde al aluminio, el que abunda más). La densidad del titanio está entre la del aluminio y la del hierro; éste y otros datos se presentan en la tabla 6.1f). En las últimas décadas su importancia ha crecido debido a sus aplicaciones aeroespaciales, en las que se aprovechan su peso ligero y razón resistencia-peso buena.
Producción de titanio Los minerales principales del titanio son el rutilo, que está formado por 98% a 99% de TiO2 , y la ilmenita, que es una combinación de FeO y TiO2 . El rutilo es preferible como mena debido a su mayor contenido de Ti. En la recuperación del metal a partir de sus minerales, el TiO2 se convierte en tetracloruro de titanio (TiCl4 ) por medio de hacer reaccionar al compuesto con cloro gaseoso. A esto sigue una secuencia de etapas de destilación para eliminar las impurezas. Luego se reduce el TiCl4 muy concentrado a titanio metálico, con una reacción con magnesio; esto se conoce como proceso Kroll. Como agente reductor también puede usarse sodio. En cualquier caso, debe mantenerse una atmósfera inerte para impedir que el O2 , N2 o H2 contaminen al Ti por su gran afinidad con esos gases. El metal resultante se emplea para fundir lingotes del metal y sus aleaciones.
Propiedades del titanio El coeficiente de expansión térmica del titanio es relativamente bajo entre los metales. Es más rígido y fuerte que el aluminio, y a altas temperaturas conserva buena resistencia. El titanio puro es reactivo, lo que da problemas durante el procesamiento, en especial en estado fundido. Sin embargo, a temperatura ambiente forma una película delgada de óxido (TiO2 ) adhesivo que recubre y proporciona una resistencia excelente contra la corrosión.
Estas propiedades han dado lugar a dos áreas principales de aplicación del titanio: 1) en estado puro comercial, el Ti se emplea para hacer componentes resistentes a la corrosión, tales como elementos marinos e implantes ortopédicos; y 2) las aleaciones de titanio se emplean como componentes de resistencia elevada en temperaturas que van de la del ambiente a 550 ºC (1 000 ºF), en especial en las que se aprovecha su excelente razón resistencia-peso. Estas aplicaciones recientes incluyen componentes de aeronaves y mísiles. Algunos de los elementos de aleación que se utilizan con el titanio incluyen aluminio, manganeso, estaño y vanadio. En la tabla 6.13 se presentan algunas composiciones y propiedades mecánicas de varias de sus aleaciones.
En la tabla 6.1g) se enlistan los datos básicos del zinc. Su punto de fusión bajo lo hace atractivo como metal de fundición. También da protección contra la corrosión cuando se le usa como recubrimiento del acero o hierro; el acero galvanizado es acero recubierto con zinc.
Producción de zinc La blenda de zinc o esfalerita es el mineral principal del zinc; contiene sulfuro de zinc (ZnS). Otras menas importantes de zinc incluyen la smithsonita, que es carbonato de zinc (ZnCO3 ), y hemimorfato, que es silicato hidroso de zinc (Zn4 Si2 O7 OHH2 O).
La esfalerita debe concentrarse (o beneficiarse, en el argot metalúrgico) debido a la cantidad tan pequeña de sulfuro de zinc que contiene. Esto se lleva a cabo por medio de triturar, en primer lugar, al mineral, luego se muele con agua en un molino de balines (véase la sección 17.1.1) para crear una pasta aguada. En presencia de un agente espumante, la pasta aguada se agita de modo que las partículas de mineral flotan en la superficie y se pueden retirar (se separan de los minerales pesados de la parte inferior). Después, el sulfuro de zinc más concentrado se calienta a 1 260 ºC (2 300 ºF), de modo que con la reacción se forma óxido de zinc (ZnO).
Hay varios procesos termoquímicos para recuperar el zinc de ese óxido, todos los cuales lo reducen por medio de carbono. El carbono se combina con el oxígeno del ZnO para formar CO y CO2 , lo que libera Zn en forma de vapor que se condensa para producir el metal deseado.
También se usa mucho un proceso electrolítico, responsable de alrededor de la mitad de la producción mundial de zinc. Dicho proceso también comienza con la preparación de ZnO, que se mezcla con ácido sulfúrico diluido (H2 SO4 ), seguido de electrólisis para separar la solución de sulfato de zinc (ZnSO4 ) resultante y producir el metal puro.
El plomo y el estaño
Es frecuente que el plomo (Pb) y el estaño (Sn) se estudien juntos debido a sus temperaturas de fusión bajas, y porque forman aleaciones para soldar que se emplean para hacer conexiones eléctricas. En la figura 6.3 se presenta el diagrama de fase del sistema estaño-plomo. Los datos básicos para ambos metales se enlistan en la tabla 6.1h).
El plomo es un metal denso con punto de fusión bajo; otras de sus propiedades son resistencia baja, poca dureza (la palabra “suave” es apropiada para describirlo), ductilidad alta y buena resistencia a la corrosión. Además de su empleo como soldadura, las aplicaciones del plomo y sus aleaciones incluyen las siguientes: tubos para plomería, rodamientos, municiones, metales tipográficos, protección contra rayos X, baterías de almacenamiento y amortiguamiento de vibraciones. También se utiliza mucho en productos químicos y pinturas. Los elementos de aleación principales para el plomo son estaño y antimonio.
El estaño tiene un punto de fusión aún más bajo que el del plomo; otras propiedades incluyen resistencia baja, poca dureza y ductilidad buena. El uso más temprano del estaño fue para hacer bronce, aleación que consistía en cobre y estaño creada alrededor de 3000 a.C. en Mesopotamia y Egipto. El bronce aún es una aleación de importancia comercial (aunque su importancia relativa ha declinado a lo largo de 5 000 años). Otros usos del estaño son para recubrir contenedores de lámina de acero (“latas de estaño”) para almacenar comida y, por supuesto, como metal de soldadura.
Los metales refractarios son aquellos capaces de soportar temperaturas elevadas. Los más importantes de este grupo son el molibdeno y el tungsteno; véase la tabla 6.1i). Otros metales refractarios son el columbio (Cb) y el tantalio (Ta). En general, estos metales y sus aleaciones pueden conservar una resistencia y dureza elevadas a temperaturas altas.
El molibdeno tiene un punto de fusión alto y es relativamente denso, rígido y fuerte. Se usa como metal puro (99.9% + % Mo) y como aleación. La aleación principal es TZM, que contiene cantidades pequeñas de titanio y zirconio (menos de 1% del total). El Mo y sus aleaciones poseen buena resistencia a alta temperatura, y a esto se deben sus tantas aplicaciones, que incluyen escudos contra el calor, elementos de calefacción, electrodos para soldadura por resistencia, troqueles para trabajos a altas temperaturas (por ejemplo, moldes para fundición a troquel) y piezas para motores de cohete y a reacción. Además de estas aplicaciones, el molibdeno también se emplea mucho como ingrediente de aleación de otros metales, como aceros y superaleaciones.
El tungsteno (W) tiene el punto de fusión más alto de todos los metales puros y es uno de los más densos. Es también el más rígido y duro de todos los metales puros. Su aplicación más conocida es el filamento de los focos incandescentes. Es común que las aplicaciones del tungsteno se caractericen por temperaturas de operación elevadas, tales como elementos para cohetes y motores a reacción, y electrodos de soldadura con arco. También se utiliza mucho como elemento de aleaciones de aceros para herramientas, resistentes al calor, y para el carburo de tungsteno.
Una desventaja grande tanto del Mo como del W es su propensión a oxidarse a temperaturas elevadas, por arriba de los 600 ºC (1 000 ºF), con lo que se perjudican sus propiedades de alta temperatura. Con el fin de superar esta deficiencia, deben emplearse recubrimientos protectores para estos metales en las aplicaciones de alta temperatura, o bien operar las piezas metálicas en un vacío. Por ejemplo, el filamento de tungsteno debe energizarse en el vacío interior de los focos.
Metales preciosos
Los metales preciosos, también llamados metales nobles debido a que son inactivos en cuanto a la química, incluyen el oro, platino y plata. Son metales atractivos, disponibles en cantidades limitadas, y a través de la historia de las civilizaciones se han empleado para acuñar monedas y respaldar el papel moneda. También se les usa mucho en joyería y aplicaciones similares que aprovechan su alto valor. Como grupo, los metales preciosos poseen densidad elevada, ductilidad buena, conductividad eléctrica alta, resistencia a la corrosión y temperaturas de fusión moderadas; véase la tabla 6.1j
El oro (Au) es uno de los metales más pesados; es suave y se le da forma con facilidad,
y posee un color amarillo distintivo que le agrega valor. Además de la moneda y joyería,
sus aplicaciones incluyen contactos eléctricos (debido a su buena conductividad eléctrica
y resistencia a la corrosión), trabajos dentales y recubrimiento de metales comunes para
fines decorativos.
El platino (Pt) es el único metal (entre los comunes) cuya densidad es mayor que la
del oro. Aunque no se usa tanto como éste, sus aplicaciones son diversas e incluyen la joyería, termopares, contactos eléctricos y equipo catalítico para el control de la contaminación
de los automóviles.
La plata (Ag) es menos cara por unidad de peso que el oro o el platino. No obstante,
su atractivo lustre “plateado” la hace un metal muy valioso para monedas, joyería y vajillas
(que incluso adoptan el nombre del metal: “platería”). También se emplea como relleno
en trabajos dentales. La plata tiene la conductividad eléctrica más elevada que cualquier
metal, lo que la hace útil para contactos en aplicaciones electrónicas. Por último, debe
mencionarse que el cloruro de plata y otros haluros del metal sensibles a la luz son la base
de la fotografía.
SUPERALEACIONES
Las superaleaciones constituyen una categoría que encuadra a los metales ferrosos y no ferrosos. Algunas de ellas están basadas en el hierro, mientras otras lo están en el níquel y el cobalto. En realidad, muchas de las superaleaciones contienen cantidades sustanciales de tres o más metales, en lugar de un solo metal base más elementos de aleación. No obstante que el tonelaje de estos metales no es significativo en comparación con la mayoría de los demás metales que se han estudiado en este capítulo, tienen importancia comercial porque son muy caros; y también la tienen en cuanto a tecnología por lo que hacen.Las superaleaciones son un grupo de aleaciones de alto rendimiento diseñadas para satisfacer requerimientos muy exigentes de fortaleza y resistencia a la degradación de su superficie (corrosión y oxidación) a varias temperaturas de uso. Para estos metales, la resistencia a la temperatura ambiente convencional no es un criterio importante, y la mayoría de ellos tiene propiedades al respecto que son buenas pero no extraordinarias. Lo que los distingue es su desempeño ante temperaturas elevadas; las propiedades mecánicas de interés son su resistencia a la tensión, dureza en caliente, resistencia al agrietamiento, y a la corrosión a temperaturas muy elevadas. Es frecuente que las temperaturas de operación estén en la cercanía de los 1 100 ºC (2 000 ºF). Estos metales se emplean mucho en sistemas de turbinas de gas, motores a reacción y de cohetes, turbinas de vapor, y plantas de energía nuclear, en los que la eficiencia de operación se incrementa con las temperaturas elevadas.
➣ Aleaciones basadas en el hierro. Como ingrediente principal tienen hierro, aunque en ciertos casos éste es menor de 50% de la composición total.➣ Aleaciones basadas en el níquel. Por lo general tienen mejor resistencia a las temperaturas altas que los aceros aleados. El níquel es el metal base. Los elementos principales de la aleación son el cromo y el cobalto; otros menores son el aluminio, titanio, molibdeno, niobio (Nb) y hierro. Algunos nombres familiares en este grupo son los de Inconel, Hastelloy y Rene 41.➣ Aleaciones basadas en el cobalto. Tienen al cobalto (alrededor del 40%) y cromo (quizá el 20%) como sus componentes principales. Otros elementos de la aleación incluyen al níquel, molibdeno y tungsteno.
En prácticamente todas las superaleaciones, inclusive las basadas en hierro, el darle resistencia se lleva a cabo mediante endurecimiento por precipitación. Las superaleaciones con base en el hierro no usan la formación de martensita para obtener su resistencia. En la tabla 6.15 se presentan las composiciones comunes para algunas de las aleaciones, en tanto que las propiedades de resistencia de ellas a temperaturas ambiente y elevada se muestran en la tabla 6.16.
GUÍA PARA EL PROCESAMIENTO DE METALES
Se dispone de una variedad amplia de procesos de manufactura para dar forma a los metales, mejorar sus propiedades, ensamblarlos y darles un acabado estético y protector.Dar forma, ensamblar y procesos de acabado Los metales reciben su forma por medio de todos los procesos básicos, inclusive fundición, metalurgia de polvos, procesos de defor mación y remoción de material. Además, las piezas metálicas se unen para formar ensambles por procesos tales como soldadura autógena, soldadura dura y soldadura suave, y sujeción mecánica. El tratamiento térmico se lleva a cabo para mejorar las propiedades. Y es común que los procesos de acabado se utilicen para mejorar la apariencia de las piezas metálicas o para dar protección contra la corrosión. Estas operaciones de acabado incluyen la galvanoplastia y la pintura. En la tabla 6.17 se da un resumen de las muchas tecnologías de procesamiento
El tratamiento térmico se refiere a varios tipos de ciclos de calentamiento y enfriamiento que se ejecutan sobre un metal para cambiar en forma benéfica sus propiedades. Operan con la alteración de la microestructura básica del metal, que a su vez determina las propiedades mecánicas. Algunas de las operaciones de tratamiento térmico sólo son aplicables a cierto tipo de metales; por ejemplo, el tratamiento térmico del acero para formar martensita es algo especializado, toda vez que la martensita es exclusiva del acero.









































Comentarios
Publicar un comentario